ÁCIDOS Y BASES DÉBILES Y FUERTES clasificación , grado de disociación y pH Ejemplos YouTube

12. Ácido oxálico C 2 H 2 O 4 o ácido etanedioico es un ácido dicarboxílico que se consigue en las hojas de espinaca. 13. Ácido úrico C 5 H 4 N 4 O 3 es un ácido diprótico producto del metabolismo de los ácidos nucleicos. Su exceso en la sangre se conoce como hiperuricemia. 14. Ácido tartárico HOOC-CHOH-CHOH-COOH o 2,3.
Problemas ÁCIDO BASE resueltos. Cálculo del pH de ácido débil y después de dilución. Química PAU

Un ácido débil es un ácido que no produce muchos iones de hidrógeno cuando está en solución acuosa. Los ácidos débiles tienen valores de pH relativamente bajos y se utilizan para neutralizar bases fuertes. Los ejemplos de ácidos débiles incluyen: ácido acético (vinagre), ácido láctico, ácido cítrico y ácido fosfórico.
Como cacular el PH ACIDOS Y BASES DEBILES YouTube

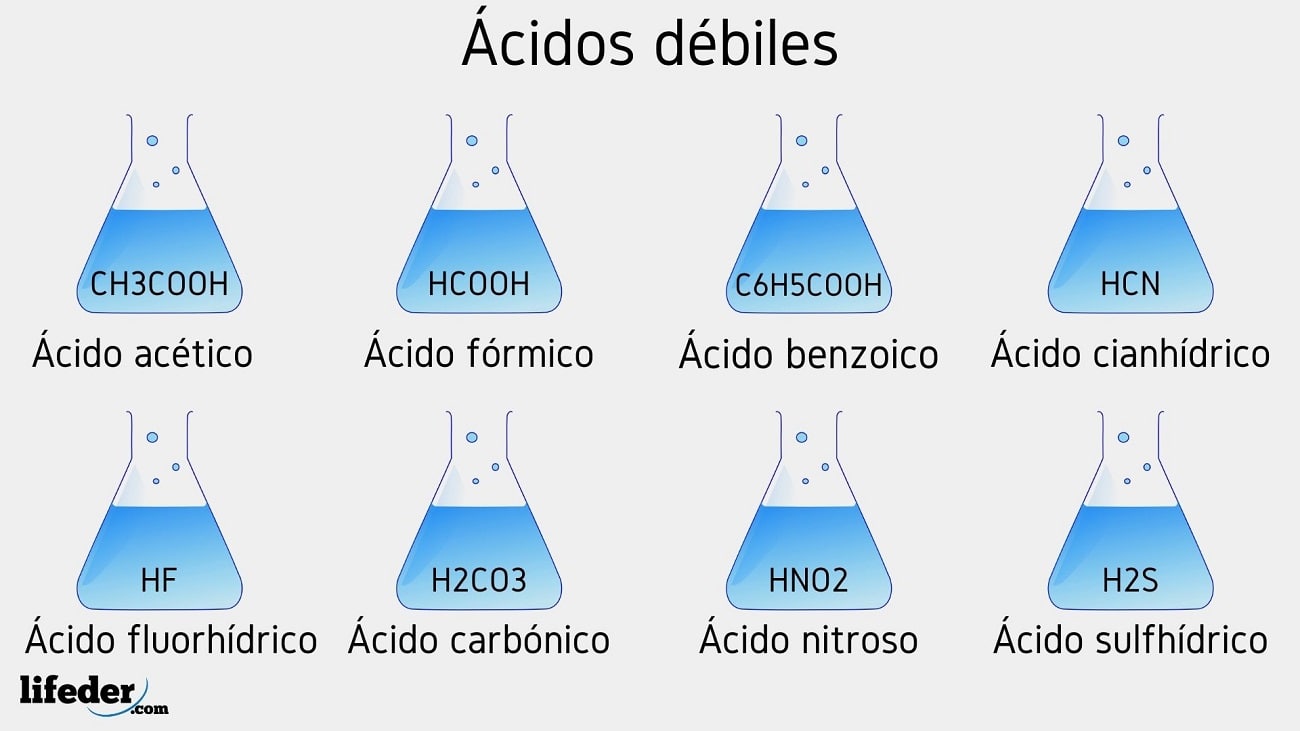
En este artículo conoceremos los 11 ejemplos de ácidos débiles. También repasaremos su concepto y porque son ácidos débiles. ¿Que son los ácidos débiles? Un ácido débil es aquel que no se disocia completamente en una solución acuosa o con el agua. Es decir, que pueden liberar una pequeña cantidad de sus iones de Hidrogeno […]
As Fórmulas Dos ácidos Da Tabela São Respectivamente

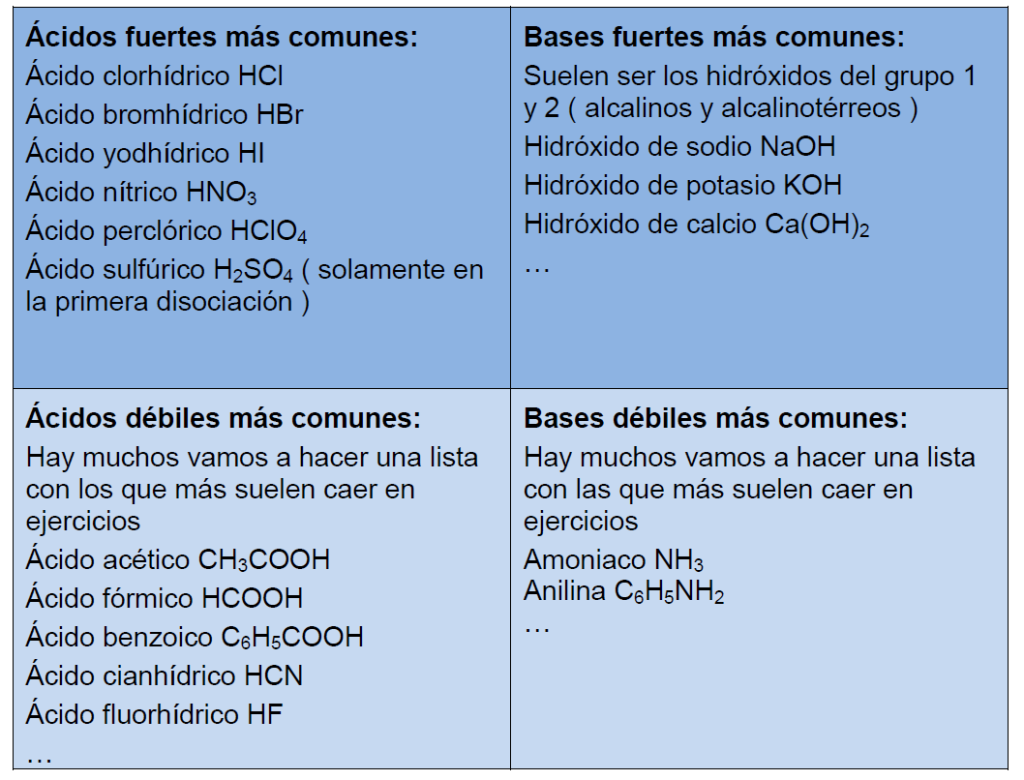
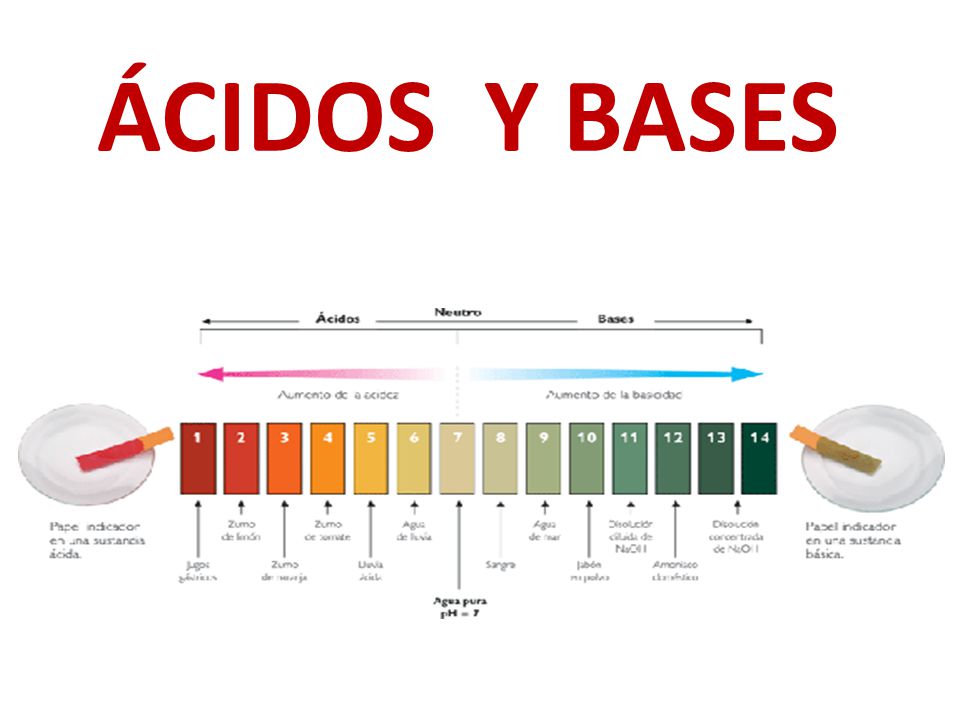
Los ácidos fuertes se disocian completamente en disoluciones acuosas, de modo que todas sus moléculas pierden al menos un protón (H +) que forma un ion hidronio (H 3 O +) con la molécula de agua, mientras que los ácidos débiles sólo se disocian parcialmente. Los ácidos fuertes son muy pocos, sólo son siete los ácidos fuertes.
¿Cuál es la diferencia entre ácidos y bases fuertes y debiles? profesor10demates
K 1 = 1,71x10 -2. Un ácido débil es aquel ácido que no está totalmente disociado en una disolución acuosa. 1 Aporta iones al medio, pero también es capaz de aceptarlos. Si representáramos el ácido con la fórmula general HA, en una disolución acuosa una cantidad significativa de HA permanece sin disociar, mientras que el resto del.
20 Ejemplos de Ácidos
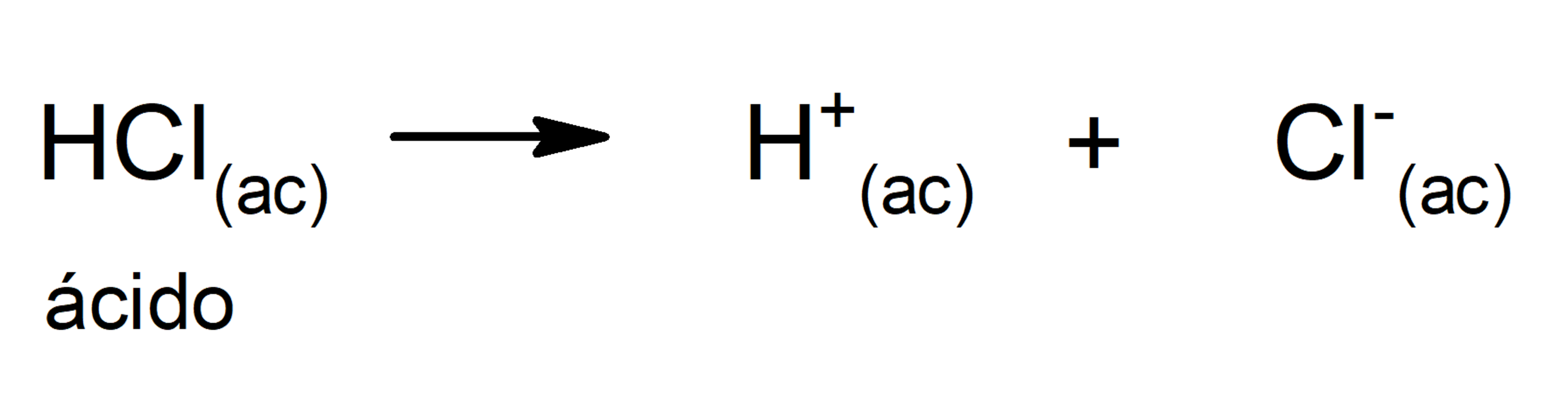
Última edición el 4 de enero de 2021 . Un ácido débil es aquel que en disolución acuosa tiene poca capacidad de disociarse en hidrógeno (H+) y en su correspondiente base conjugada. A diferencia de los ácidos fuertes, cuya disociación es completa (100%) y prácticamente irreversible, los ácidos débiles apenas se disocian y de un modo.
pH Ácidos fuertes y débiles Par ácidobase conjugada YouTube
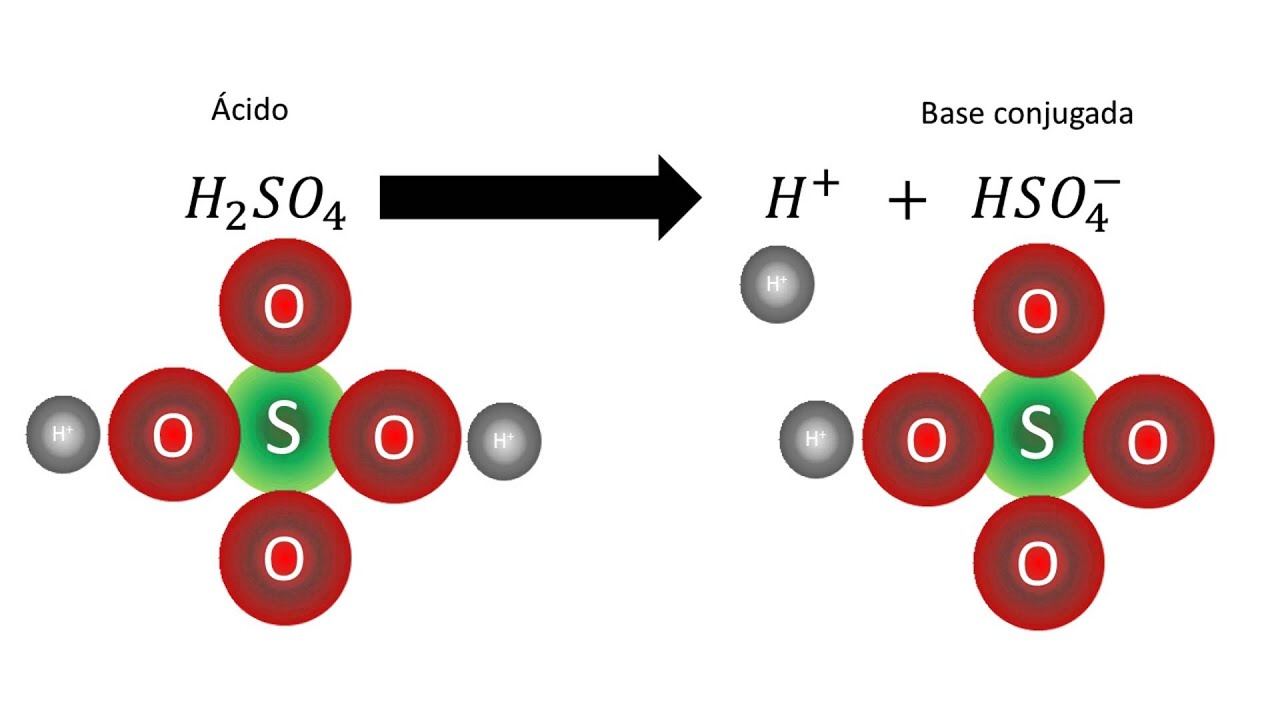
Ej: ácido cítrico. Sulfónicos: compuesto con fórmula R-S(=O)2-OH donde R es una cadena carbonada. Ej: CH3SO2OH. SEGÚN LA FUERZA DEL ÁCIDO: Ácidos Fuertes: en disolución acuosa se disocia completamente (HA → H+ + A-). HCl, H2SO4. Ácidos Débiles: en disolución acuosa se disocia parcialmente (HA ↔ H+ + A-).
5 ejemplos de ácidos fuertes y uno debil Brainly.lat

Cálculo de pH Ácidos y Bases Débiles Parte 1 YouTube

con su ácido conjugado BH +. . , la constante de equilibrio tiene la forma: K b = [ BH +] [ OH −] [ B] La constante de disociación básica (o constante de ionización básica) K b. . cuantifica el grado de ionización de una base débil. Cuanto mayor es el valor de K b. .
¿Cómo se forman los Ácidos, Bases y Sales?
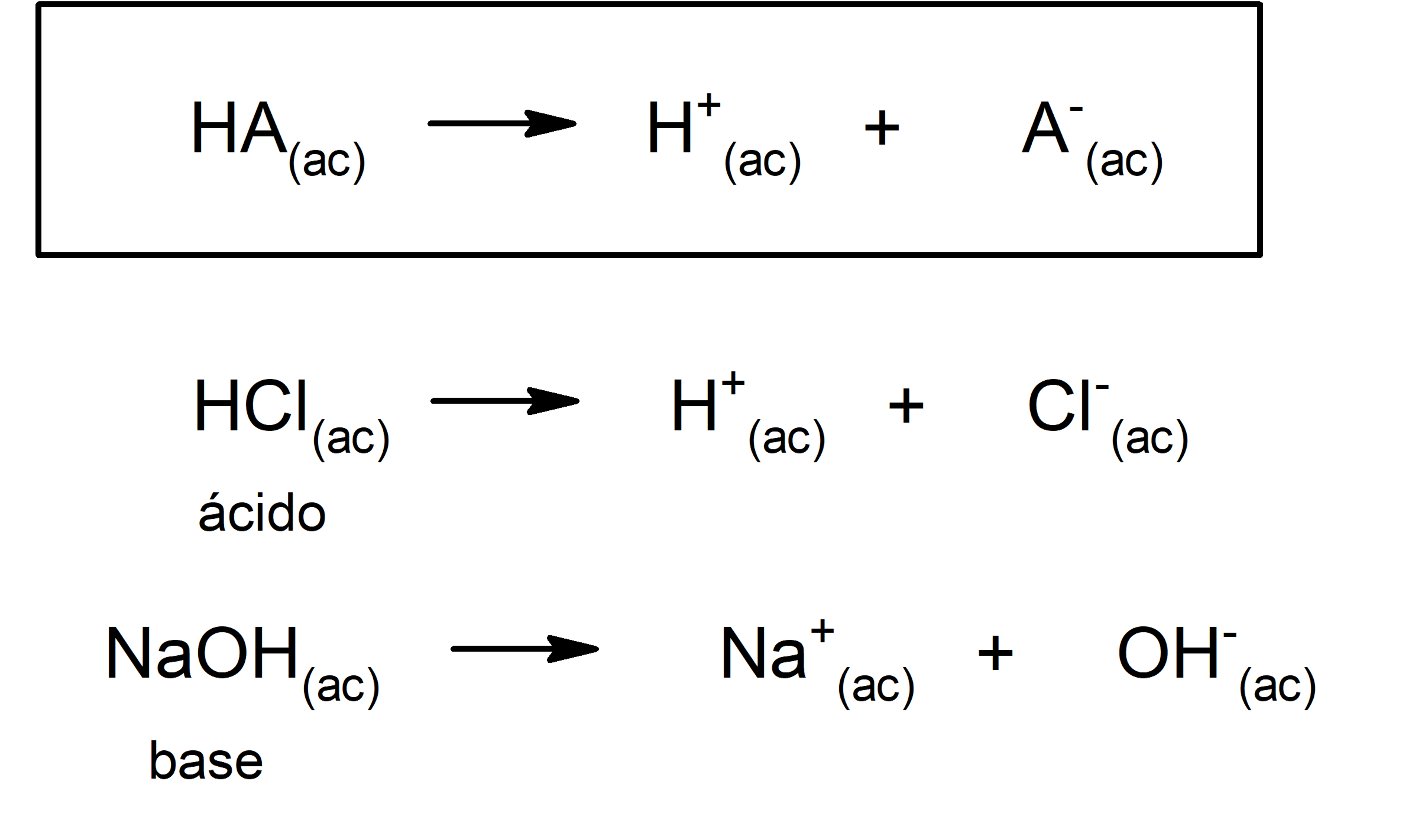
Estos ácidos tienen propiedades particulares debido a su capacidad para disociarse parcialmente en solución acuosa. Algunos ejemplos de ácidos débiles incluyen el ácido acético (CH3COOH), el ácido cítrico (C6H8O7) y el ácido láctico (C3H6O3). Estos ácidos se encuentran comúnmente en productos cotidianos como vinagre, jugos de frutas.
Ácido débil definición, características, cálculo, ejemplos
El pKa es el logaritmo negativo de Ka, y pKb es el logaritmo negativo de Kb. Los valores de pKa más pequeños indican un ácido fuerte y los valores de pKb más pequeños indican una base fuerte. Los ácidos fuertes incluyen: Ácido clorhídrico (HCl) : pKa -7. Ácido sulfúrico (H 2 SO 4 : pKa -3 a -2.
Bases fuertes y debiles Apuntes de Bioquímica Docsity

Así: un ácido y una base son fuertes cuando se ionizan completamente, es decir, en el proceso de ionización se transforman completamente en cationes o iones positivos y en aniones o iones negativos. Por otro lado, un ácido y una base son débiles cuando en el agua se ionizan parcialmente, esto es, en solución habrá una proporción de.
Acidos Y Bases Dibujos Tados
La mayoría de los ácidos orgánicos son ácidos débiles. Aquí hay una lista parcial, ordenada de más fuerte a más débil. ho 2 c 2 o 2 h - ácido oxálico. h 2 so 3 - ácido sulfuroso. hso 4 - - ion sulfato de hidrógeno. h 3 po 4 - ácido fosfórico. hno 2 - ácido nitroso. hf - ácido fluorhídrico. hco 2 h - ácido metanoico.